李聪,复旦大学教授,博士生导师,教育部新世纪人才,上海市教委曙光计划人才。1993年9月至2000年7月于武汉大学化学系获得学士、硕士学位。2004年10月于香港大学化学系获博士学位。2005年4月至2008年12月在美国约翰-霍普金斯大学医学院放射学系从事博士后研究。2008年12月作为引进人才赴复旦大学药学院工作,先后担任副教授、教授、放射药学教研室主任、科研副院长。
回国工作以来,主持国家自然科学基金项目5项、上海市科委重点项目3项,以研究骨干身份参与973重大科学研究计划3项,到位基金800余万元。以第一/通讯作者身份在Adv. Mater.、Angew. Chem. Int. Ed.、ACS Nano、Nano Lett.、Chem. Sci.、Theranostics、Int. J. Cancer、J. Cereb. Blood Flow Metab.等权威杂志发表SCI论文40篇,其中5篇影响因子大于10,平均影响因子为7.2,被引用次数超过1300次。相关工作被Nat. Cancer. Rev.、Chem. Rev.、Sci. Trans. Med.等顶级学术刊物正面评价。相关工作获申请专利12项,授权4项。2015年获国家科技进步二等奖 "中枢神经系统重大疾病CT/MRI关键技术与应用",(第2完成人);2014年获上海市科技进步二等奖 "肝纤维化无创伤诊断新方法的创建及其靶向治疗",(第5完成人);2011年或教育部科技进步一等奖 “磁共振分子影像和功能影像研究和应用”,(第5完成人);2017年获上海市浦东新区优秀科技论文一等奖。
李聪教授研究工作聚焦于“脑胶质瘤微环境演变与调控”关键科学问题,针对胶质瘤“精准定位难”、“完整切除难”、“有效治疗难”、“复发控制难”等临床困境开展研究。通过开发多模态、多尺度、多维度分子影像技术和跨血脑屏障微环境响应型分子探针,在脑胶质瘤“精准定位”、“手术导航”、“药物递送”、“靶向治疗”和“微环境调控”等关键环节取得积极进展。

(一)“开合有度”:靶向、高效、安全调控血脑屏障通透性新策略
血脑屏障作为脑部毛细血管特殊结构对维持大脑稳态发挥关键作用,而处于肿瘤浸润区域血脑屏障的结构与功能演变与胶质瘤进展和预后密切相关。内皮细胞间“紧密连接”是维持血脑屏障功能的关键。目前临床使用高渗剂如甘露醇通过提高毛细血管两侧的渗透压“挤破”紧密连接从而提高血脑屏障通透性。但该方法对血脑屏障不可控开启往往引起脑水肿和神经损伤等副作用。因此,研究浸润区域血脑屏障结构演变和调控机制、发展高效、安全、靶向调控胶质瘤边缘区域血脑屏障通透性策略具有重要科研和临床意义。
李聪教授课题组制备了一种基于树枝状高分子的纳米激动剂。该纳米激动剂可特异激活脑毛细血管内皮细胞上的腺苷A2A受体从而引起内皮细胞收缩、紧密连接暂时性开启。活体磁共振成像证实纳米激动剂能够显著提高正常小鼠脑血管通透性及模型药物入脑效率。透射电镜直接观察到紧密连接的开启及可逆恢复。免疫荧光显微成像表明血管基膜、周细胞、胶质细胞周足和内皮细胞等血脑屏障主要结构未有损伤。组织切片也未发现脑水肿、细胞凋亡、神经损伤等副作用。纳米激动剂的优势在于:1. 通过强化内源性机制可逆调控血脑屏障通透性,安全性好;2. 通过调控激动基团数目调节血脑屏障开启效率和时间窗口,为不同类型药物个性化入脑提供新的途径(ACS Nano,2014,?8, 3678;?J. Cereb. Blood Flow Metab.,?2017,?37, 1410, DOI: 10.1177/0271678X16656198)。
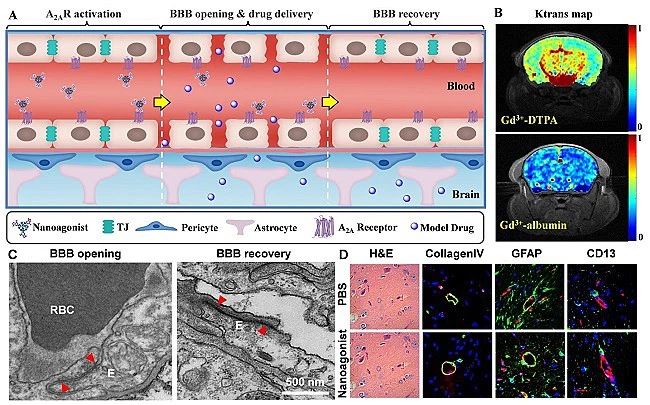
图1.腺苷2A受体激动剂可逆调控血脑屏障通透性。(A)纳米激动剂可逆开启BBB示意图;(B)动态增强磁共振成像(DCE-MRI)显示纳米激动剂提高BBB通透性;(C)透射电镜显示注射纳米激动剂后紧密连接的开启及可逆恢复;(D)组织染色表明血管基膜、胶质细胞周足、周细胞和内皮细胞等BBB主要组分未有损伤,也未发现脑水肿、神经凋亡等副作用。
(二)“眼见为实”:靶向调控胶质瘤边缘区域血脑屏障通透性指导化疗药物递送
由于血脑屏障的低通透性,大约98%的小分子及绝大多数的大分子药物难以跨越血脑屏障入脑。尽管胶质瘤核心区域血脑屏障结构破坏明显,但其浸润区则基本保持完整,这也是导致该区域难以示踪、难以递药、易于复发等关键原因。李聪教授课题组构建了一类腺苷2A受体(A2AR)靶向激动剂,其首先靶向胶质瘤浸润区域的新生血管,通过特异性激活A2AR信号通路,暂时性提高血脑屏障通透性。当无创影像技术发现胶质瘤浸润区域和与周围正常脑组织通透性比值达到最大时,注射化疗药物,在提高药物疗效同时降低其对正常组织的毒副作用。
血脑屏障阻止药物入脑并发挥疗效是几乎所有中枢神经系统疾病治疗面临的共同难题。基于腺苷受体激动剂的血脑屏障靶向调控技术和影像指导下的递药策略可以拓展到包括脑血管疾病、神经退行性疾病和精神类疾病等其他中枢神经系统疾病的治疗,具有重要的科学和临床意义(Theranostics,?2018,8, 3126)。
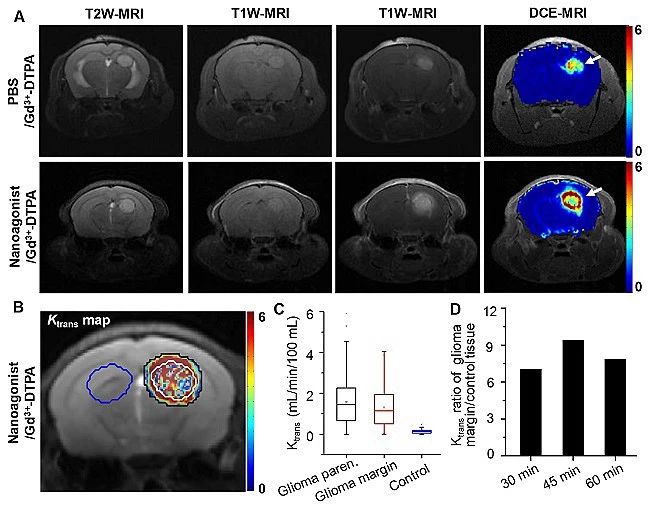
图2.调控胶质瘤边缘区域血脑屏障通透性指导化疗药物递送。(A)尾静脉注射Gd3+-DTPA(上排)或靶向激动剂Den-RGD-Reg联合Gd3+-DTPA(下排)处理后的胶质瘤原位移植裸鼠T2W-MR、T1W-MR和DCE-MR图像。(B)靶向纳米激动剂处理后小鼠脑部的Ktrans图。注射纳米激动剂45 min后再注射Gd3+-DTPA,白线圈出区域为肿瘤实质部分,白线圈和黑线圈之间为肿瘤边缘,蓝线圈出区域为对照脑组织。(C)注射纳米激动剂后,胶质瘤实质、胶质瘤边缘和对照脑组织的平均Ktrans值。(D)注射纳米激动剂30 min、45 min、60 min后在胶质瘤边缘和对照脑组织间的Ktrans比值。
(三)“双管齐下”:肿瘤微环境双模态响应探针引导脑胶质瘤手术切除
手术切除是胶质瘤治疗的重要手段。保守切除残留的微小病灶会导致肿瘤早期复发,而激进切除则有可能破坏肿瘤周围的重要功能区,造成失语、瘫痪等严重后遗症。李聪课题组制备了一类肿瘤微环境双模态响应探针引导脑胶质瘤手术切除。该类探针通过受体介导转胞吞作用跨越血脑屏障。在肿瘤酸性环境中特异性自组装形成三维球状聚集体并伴随T1加权磁共振信号和表面增强拉曼信号同时增强。高信噪比磁共振成像用于手术前胶质瘤准确定位,而具有超高灵敏(10-12-10-15?M)的表面增强拉曼信号用于手术中引导肿瘤切除”。由于酸性环境是几乎所有固体肿瘤普遍特征,pH响应探针将较少受到肿瘤异质性影响,可实现不同类型胶质瘤普适性示踪和导航;此外胶质瘤浸润区域血脑屏障结构相对完整。跨血脑屏障探针能够提高对胶质瘤边缘的示踪信噪比和准确率”。
双模态响应型探针能够实现手术前肿瘤磁共振定位像和手术中拉曼导航像的实时比对,若能应用于临床,则有望克服开颅手术过程中脑移位造成的导航信号偏倚,对提高胶质瘤浸润部位切除率并避免损伤邻近重要脑功能区均有积极临床意义(Adv. Mater.,?2017,?29, 1603917;?Nanoscale,?2017,?9, 7930)。

图3. pH双模态响应探针引导胶质瘤切除示意图
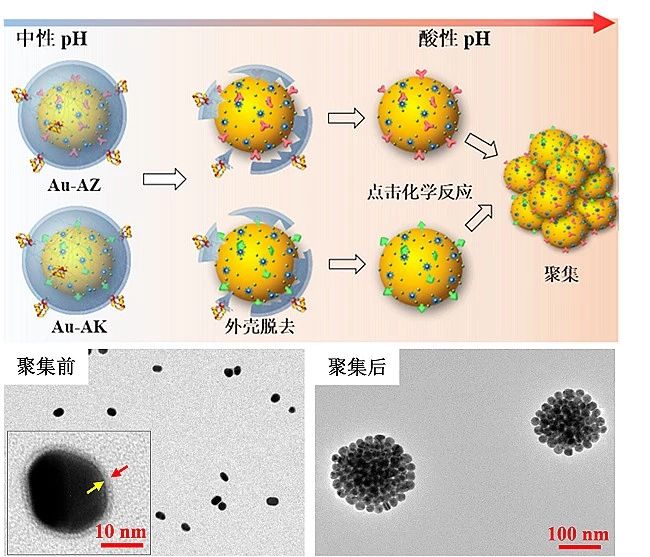
图4. 探针在肿瘤酸性环境中特异性聚集
(四)“正中靶心”:纳米抑制剂阻断MET通路提高脑胶质瘤靶向治疗疗效
间质上皮转化因子(mesenchymal-epithelial transition factor, MET)蛋白是一类跨膜受体,属于络氨酸激酶受体超家族,也是肝素生长因子的特异性受体。MET受体活化能够激活多种下游信号通路,促进肿瘤细胞的增殖、侵袭和转移。MET通路异常与肿瘤耐药、转移风险,不良预后等呈正向相关。MET信号过度活化与胶质瘤预后密切相关。研究发现,29%的高级别胶质瘤病人具有MET过度活化特征,且这些病人的中位生存期较MET低表达或不表达病人平均缩短2.6个月。发展新类型的MET抑制剂,不但可以作为抗体和小分子抑制剂外的另一种选择,在降低治疗成本、提高治疗效果,克服耐药性等方面有重要的临床意义。
cMBP是MET受体特异性靶向多肽,可抑制其下游信号通路的激活,但其循环时间短,易被降解。本工作将多条cMBP连接于树枝状高分子得到的纳米抑制剂具有多位点效应。与游离cMBP相比,纳米抑制剂对MET受体的结合常数分别提高了32倍和332倍。与游离cMBP多肽相比,纳米抑制剂对U87MG肿瘤细胞呈浓度依赖性抑制。免疫印迹分析结果证明纳米抑制剂能够以浓度依赖性方式有效抑制MET及其下游各个关键信号通路蛋白的磷酸化。而且病人脑胶质瘤和U87MG原位移植瘤切片均显示pMET在胶质瘤边缘,特别是肿瘤血管腔侧高表达,而在正常脑组织表达量很低。该纳米抑制剂可以有效抑制MET信号通路的活化,实现与小分子抑制剂相当的抗肿瘤作用,有望成为抗体和小分子抑制剂外的另一种新类型的MET抑制剂并克服靶向治疗耐药性问题(Nano Lett.,?2018,?18, 5488-5498)。

图5. 纳米抑制剂阻止MET受体的二聚化及下游多种信号通路活化
(五)“否极泰来”:调控小胶质细胞表型极化优化神经炎性微环境
小胶质细胞(Microglia)是脑部驻地免疫细胞,为中枢神经系统最主要的免疫防线。小胶质细胞在生理条件下处于静息态(M0表型),发挥“免疫监视”作用。病理状态下,小胶质细胞迅速激活并伴随转录适应性功能变化。经典激活型(M1极化)小胶质细胞释放促炎因子和毒性物质杀灭病原体。而替代激活型(M2极化)小胶质细胞则通过促进组织修复和再生实现神经保护作用。过度激活的M1表型小胶质细胞会引起神经元失能、损伤和退变,并在脑血管疾病、神经退行性疾病、神经发育障碍和精神性疾病中扮演重要角色。因此,调控小胶质细胞表型极化将为治疗炎性相关神经系统疾病提供新的思路。
胞内活性氧簇(ROS)在小胶质细胞表型极化过程中发挥关键作用。例如,抑制线粒体电子传递链提高ROS浓度可促进M1型极化。同时,抑制NADPH氧化酶活性降低ROS浓度可阻止M1型极化。因此,改变胞内ROS水平可能调控小胶质细胞表型极化。该研究构建了直径小于5纳米的氧化铈纳米粒,其表面共存Ce3+和Ce4+两种价态,价态间的相互转换赋予纳米铈同时、高效、持续性消除过氧化氢(H2O2)、超氧阴离子(O2-)及羟自由基(OH)等多种ROS的能力。实验结果显示:乏氧条件下,纳米铈能够阻断NF-κB炎性信号通路,抑制iκB磷酸化降解和P65的核转移,降低促炎性细胞因子表达水平同时提高抑炎性细胞因子表达,最终促进病理条件下小胶质细胞M1到M2表型逆转。经纳米铈预孵育的小胶质细胞降低了乏氧条件下共孵育神经元细胞的死亡,显示出神经保护效应。该项工作揭示了ROS在调控小胶质细胞表型极化中的关键作用,为病理条件下促使脑内免疫微环境再平衡提供了新途径(Angew. Chem. Int. Ed.,?2018,?130, 5910)。
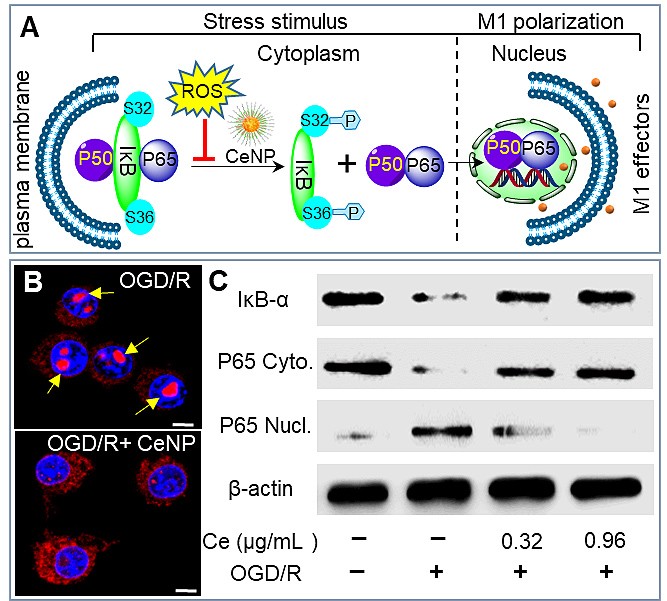
图6. 纳米铈消除ROS调控小胶质细胞表型极化相关机制图
以上为李聪课题组近年来具有代表性的工作成果,其它更多具体详细的信息参见下列网站,或发送邮件至congli@fudan.edu.cn。
导师介绍李聪https://www.x-mol.com/university/faculty/17020
课题组网站congli.fudan.edu.cn
放射药学教研室网站http://spfdu.fudan.edu.cn/Department/Index.aspx?BID=81
